در ساعات اولیه ۲۹ دسامبر، NEJM یک مطالعه بالینی فاز III جدید از ویروس کرونای جدید چینی VV116 را به صورت آنلاین منتشر کرد. نتایج نشان داد که VV116 از نظر مدت زمان بهبودی بالینی بدتر از Paxlovid (نماتوویر/ریتوناویر) نیست و عوارض جانبی کمتری دارد.
منبع تصویر:NEJM
میانگین زمان بهبودی ۴ روز، میزان عوارض جانبی ۶۷.۴٪
VV116 یک داروی نوکلئوزیدی خوراکی ضد ویروس کرونای جدید (SARS-CoV-2) است که با همکاری Junsit و Wang Shan Wang Shui ساخته شده است و به همراه Remdesivir شرکت Gilead، molnupiravir شرکت Merck Sharp & Dohme و azelvudine شرکت Real Biologics، یک مهارکننده RdRp محسوب میشود.
در سال 2021، یک کارآزمایی بالینی فاز II از VV116 در ازبکستان به پایان رسید. نتایج این مطالعه نشان داد که گروه VV116 در مقایسه با گروه کنترل، میتوانند علائم بالینی را بهتر بهبود بخشند و خطر پیشرفت به فرم بحرانی و مرگ را به میزان قابل توجهی کاهش دهند. بر اساس نتایج مثبت این کارآزمایی، VV116 در ازبکستان برای درمان بیماران مبتلا به کووید-19 متوسط تا شدید تأیید شده است و به اولین داروی جدید خوراکی کرونری تبدیل شده است که برای بازاریابی در خارج از کشور در چین تأیید شده است [1].
این کارآزمایی بالینی فاز III[2] (NCT05341609)، به رهبری پروفسور ژائو رن از بیمارستان رویجین شانگهای، پروفسور گائویوان از بیمارستان رنجی شانگهای و آکادمیسین نینگ گوانگ از بیمارستان رویجین شانگهای، در طول شیوع ناشی از گونه اومیکرون (B.1.1.529) از ماه مارس تا مه در شانگهای، با هدف ارزیابی اثربخشی و ایمنی VV116 در مقابل Paxlovid برای درمان زودهنگام بیماران مبتلا به کووید-19 خفیف تا متوسط، تکمیل شد. هدف، ارزیابی اثربخشی و ایمنی VV116 در مقابل Paxlovid برای درمان زودهنگام بیماران مبتلا به کووید-19 خفیف تا متوسط بود.
منبع تصویر: مرجع ۲
یک کارآزمایی چند مرکزی، کور از ناظر، تصادفی و کنترلشده روی ۸۲۲ بیمار بزرگسال کووید-۱۹ در معرض خطر بالای پیشرفت بیماری و با علائم خفیف تا متوسط، بین ۴ آوریل و ۲ مه ۲۰۲۲ برای ارزیابی واجد شرایط بودن شرکتکنندگان از هفت بیمارستان در شانگهای چین انجام شد. در نهایت، ۷۷۱ شرکتکننده یا VV116 (۳۸۴، ۶۰۰ میلیگرم هر ۱۲ ساعت در روز اول و ۳۰۰ میلیگرم هر ۱۲ ساعت در روزهای ۲ تا ۵) یا Paxovid (۳۸۷، ۳۰۰ میلیگرم نیماتوویر + ۱۰۰ میلیگرم ریتوناویر هر ۱۲ ساعت به مدت ۵ روز) را به عنوان داروی خوراکی دریافت کردند.
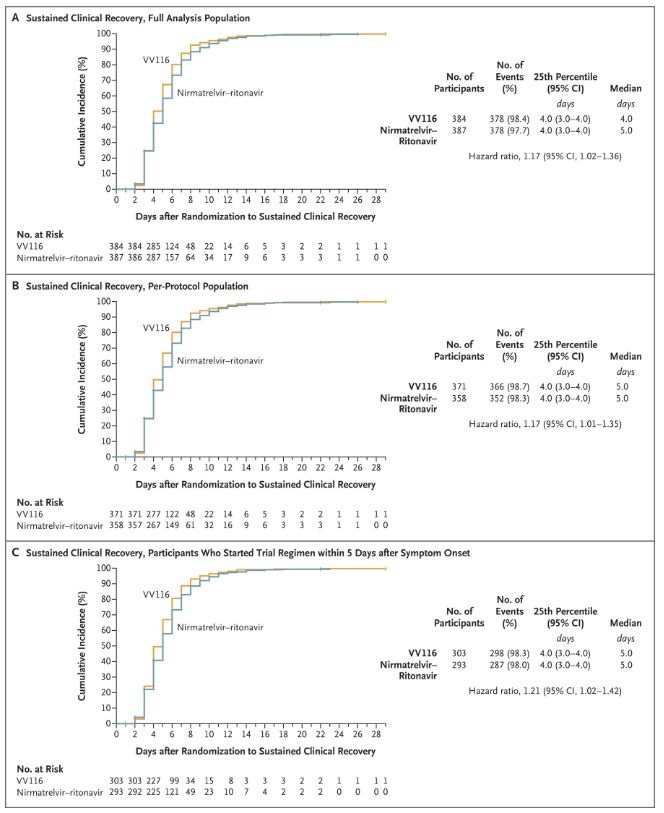
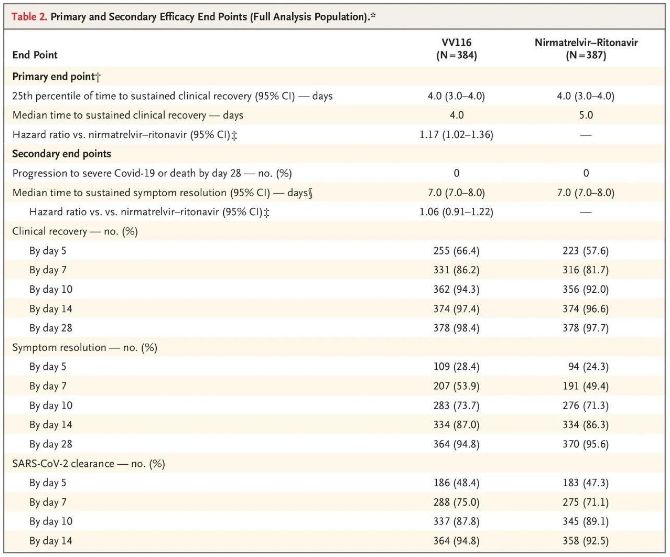
نتایج این مطالعه بالینی نشان داد که درمان زودهنگام با VV116 برای کووید-19 خفیف تا متوسط، به نقطه پایانی اولیه (زمان بهبودی بالینی پایدار) پیشبینیشده توسط پروتکل بالینی رسید: میانگین زمان بهبودی بالینی در گروه VV116، 4 روز و در گروه Paxlovid، 5 روز بود (نسبت خطر، 1.17؛ 95% فاصله اطمینان، 1.02 تا 1.36؛ حد پایین >0.8).
حفظ زمان بهبودی بالینی
نقاط پایانی اثربخشی اولیه و ثانویه (تحلیل جامع جمعیت)
منبع تصویر: مرجع ۲
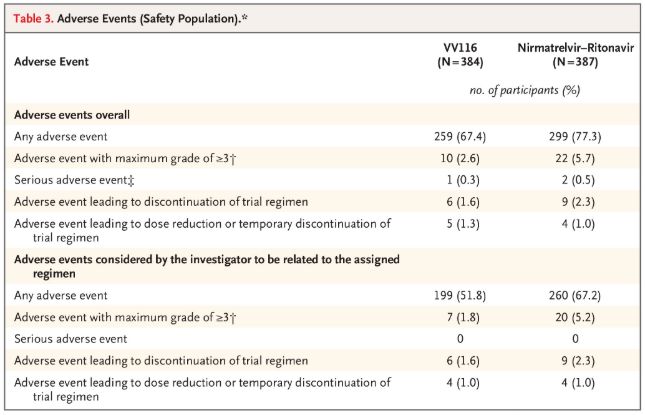
از نظر ایمنی، شرکتکنندگانی که VV116 دریافت کردند، در پیگیری 28 روزه، عوارض جانبی کمتری (67.4٪) نسبت به شرکتکنندگانی که Paxlovid (77.3٪) دریافت کردند، گزارش کردند و میزان بروز عوارض جانبی درجه 3/4 برای VV116 (2.6٪) کمتر از Paxlovid (5.7٪) بود.
رویدادهای نامطلوب (افراد ایمن)
منبع تصویر: مرجع ۲
جنجالها و پرسشها
در ۲۳ مه ۲۰۲۲، شرکت جونیپر فاش کرد که مطالعه بالینی ثبت فاز III VV116 در مقابل PAXLOVID برای درمان زودهنگام کووید-۱۹ خفیف تا متوسط (NCT05341609) به نقطه پایانی اولیه مطالعه خود رسیده است.
منبع تصویر: مرجع ۱
در زمانی که جزئیات کارآزمایی در دسترس نبود، جنجال پیرامون مطالعه فاز سوم دو جنبه داشت: اولاً، این مطالعه یک مطالعه یک سو کور بود و در غیاب گروه کنترل دارونما، بیم آن میرفت که قضاوت کاملاً بیطرفانه در مورد دارو دشوار باشد؛ ثانیاً، در مورد نقاط پایانی بالینی سؤالاتی وجود داشت.
معیارهای ورود بالینی برای جونیپر عبارتند از (۱) نتایج مثبت برای آزمایش جدید کراون، (۲) یک یا چند علامت خفیف یا متوسط کووید-۱۹، و (۳) بیمارانی که در معرض خطر بالای ابتلا به کووید-۱۹ شدید، از جمله مرگ، هستند. با این حال، تنها نقطه پایانی بالینی اولیه «زمان لازم برای بهبودی بالینی پایدار» است.
درست قبل از اعلام این خبر، در 14 می، شرکت جونیپر با حذف یکی از نقاط پایانی اولیه بالینی، یعنی «نسبت تبدیلها به بیماری جدی یا مرگ» [3]، نقاط پایانی بالینی را اصلاح کرده بود.
منبع تصویر: مرجع ۱
این دو نکته اصلی مورد اختلاف نیز به طور خاص در مطالعه منتشر شده مورد توجه قرار گرفته است.
با توجه به شیوع ناگهانی بیماری اومیکرون، تولید قرصهای دارونما برای پکسلوید قبل از شروع آزمایش تکمیل نشده بود و بنابراین محققان نتوانستند این آزمایش را با استفاده از یک طرح دوسوکور و دو نمونه آزمایشی انجام دهند. در مورد جنبه یکسوکور این آزمایش بالینی، جونیپر گفت که این پروتکل پس از ارتباط با مقامات نظارتی انجام شده است و طرح یکسوکور به این معنی است که نه محقق (از جمله ارزیاب نقطه پایانی مطالعه) و نه حامی مالی، تا زمانی که پایگاه داده نهایی در پایان مطالعه قفل نشود، از تخصیص داروی درمانی خاص اطلاع نخواهند داشت.
تا زمان تجزیه و تحلیل نهایی، هیچ یک از شرکتکنندگان در آزمایش، مرگ یا پیشرفت به یک رویداد شدید کووید-19 را تجربه نکرده بودند، بنابراین نمیتوان در مورد اثربخشی VV116 در جلوگیری از پیشرفت به کووید-19 شدید یا بحرانی یا مرگ نتیجهگیری کرد. دادهها نشان داد که میانگین زمان تخمینی از تصادفیسازی تا پسرفت پایدار علائم هدف مرتبط با کووید-19 در هر دو گروه 7 روز (95% CI، 7 تا 8) بود (نسبت خطر، 1.06؛ 95% CI، 0.91 تا 1.22) [2]. توضیح اینکه چرا نقطه پایانی اولیه «میزان تبدیل به بیماری شدید یا مرگ» که در ابتدا قبل از پایان آزمایش تعیین شده بود، حذف شد، دشوار نیست.
در 18 مه 2022، مجله Emerging Microbes & Infections نتایج اولین آزمایش بالینی VV116 را در بیماران آلوده به گونه Omicron [4] منتشر کرد، یک مطالعه کوهورت آیندهنگر و باز با 136 بیمار بستری تایید شده.
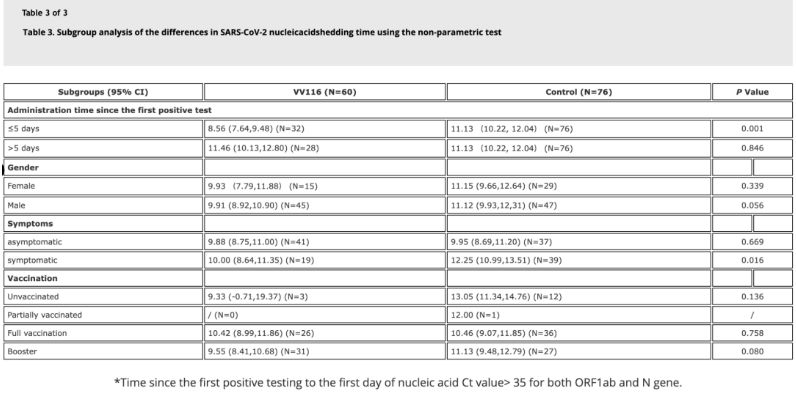
دادههای این مطالعه نشان داد که بیماران مبتلا به عفونت اومیکرون که ظرف ۵ روز از اولین آزمایش مثبت اسید نوکلئیک خود از VV116 استفاده کردند، زمان لازم برای پسرفت اسید نوکلئیک ۸.۵۶ روز بود که کمتر از ۱۱.۱۳ روز در گروه کنترل است. تجویز VV116 به بیماران علامتدار در بازه زمانی این مطالعه (۲ تا ۱۰ روز از اولین آزمایش مثبت اسید نوکلئیک) زمان پسرفت اسید نوکلئیک را در همه بیماران کاهش داد. از نظر ایمنی دارو، هیچ عارضه جانبی جدی در گروه درمان با VV116 مشاهده نشد.
منبع تصویر: مرجع ۴
سه کارآزمایی بالینی در حال انجام بر روی VV116 وجود دارد که دو مورد از آنها مطالعات فاز III بر روی کووید-19 خفیف تا متوسط (NCT05242042، NCT05582629) هستند. کارآزمایی دیگر برای کووید-19 متوسط تا شدید، یک مطالعه بالینی فاز III چند مرکزی، تصادفی و دوسوکور بینالمللی (NCT05279235) است که برای ارزیابی اثربخشی و ایمنی VV116 در مقایسه با درمان استاندارد انجام میشود. طبق اعلام Juniper، اولین بیمار در مارس 2022 ثبت نام و دوز دارو دریافت کرد.
منبع تصویر: clinicaltrials.gov
منابع:
[1]Junshi Biotech: اطلاعیهای در مورد نقطه پایانی اصلی مطالعه بالینی ثبت شده فاز III VV116 در مقابل PAXLOVID برای درمان زودهنگام COVID-19 خفیف تا متوسط
[2]https://www.nejm.org/doi/full/10.1056/NEJMoa2208822?query=featured_home[3]https://clinicaltrials.gov/ct2/show/record/NCT05341609[4] انسی ما، جینگ ون، ژنگونگ آی، ژیوانگانگینگ زو، هائو یین، ژیرن فو، هائو زینگ، لی لی، لیینگ سون، هیو هوانگ، کوانبائو ژانگ، لینلین ژو، یانتینگ جین، روئی چن، گویوئه لو، ژیجون ژو، ون هانگ ژانگ، ژنگسین وانگ. (2022) مشخصات عفونت های Omicron و وضعیت واکسیناسیون در بین 1881 گیرنده پیوند کبد: یک گروه گذشته نگر چند مرکزی. میکروبها و عفونتهای نوظهور، 11:1، صفحات 2636-2644.
زمان ارسال: ژانویه-06-2023
 中文网站
中文网站